
Las enfermedades neoplásicas son la segunda causa principal de muerte en el mundo, y se espera que el número de nuevos casos aumente significativamente en las próximas décadas.
La malnutrición es común en pacientes con cáncer, resultado tanto de la presencia del tumor como de los tratamientos médicos y quirúrgicos contra el cáncer. La malnutrición afecta negativamente la calidad de vida y la toxicidad del tratamiento, estimándose que hasta el 10-20% de los pacientes con cáncer mueren por consecuencias de la malnutrición en lugar del tumor mismo. Por lo tanto, la nutrición juega un papel crucial en el cuidado multimodal del cáncer.
Hay evidencia sólida de que los problemas nutricionales deben considerarse desde el momento del diagnóstico de cáncer, dentro de un camino diagnóstico y terapéutico, y deben ir en paralelo a los tratamientos antineoplásicos. Sin embargo, a nivel mundial, la malnutrición relacionada con el cáncer sigue siendo ampliamente no reconocida, subestimada y no tratada en la práctica clínica.
Para detectar alteraciones nutricionales en una etapa temprana, se recomienda evaluar regularmente la ingesta nutricional, los cambios de peso y el índice de masa corporal (IMC) desde el diagnóstico de cáncer y repetir según la estabilidad de la situación clínica. En pacientes con resultados anormales en el cribado, se recomienda una evaluación objetiva y cuantitativa de la ingesta nutricional, los síntomas que afectan la nutrición, la masa muscular, el rendimiento físico y el grado de inflamación sistémica.
Se recomienda que el gasto energético total (GET) de los pacientes con cáncer, si no se mide individualmente, se asuma similar al de sujetos sanos, generalmente entre 25 y 30 kcal/kg/día. Es conocido que una dieta insuficiente conduce a malnutrición crónica. Para mantener un estado nutricional estable, la dieta debe satisfacer los requisitos energéticos del paciente, que son la suma del gasto energético en reposo (GER), la actividad física y, en un pequeño porcentaje, la termogénesis inducida por la dieta. En pacientes con cáncer, el GER determinado por calorimetría indirecta ha sido reportado como inalterado, aumentado o disminuido en relación con controles sin tumor. Por lo tanto, parece sensato iniciar la terapia nutricional asumiendo que el GET sea similar al de los controles sanos. El GET puede estimarse a partir de fórmulas estándar para el GER y valores estándar para el nivel de actividad física. Se recomienda que la ingesta de proteínas sea superior a 1 g/kg/día y, si es posible, hasta 1,5 g/kg/día.
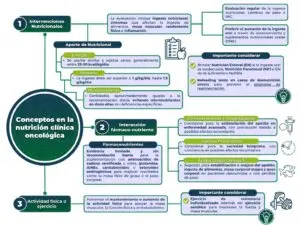
La síntesis de proteínas musculares no disminuye en pacientes con cáncer y responde al suministro dietético de aminoácidos, aunque en una cantidad algo mayor que en individuos jóvenes y sanos. Además, se aconseja que las vitaminas y minerales se suministren en cantidades aproximadamente iguales a la ingesta diaria recomendada, y se desaconseja el uso de micronutrientes en altas dosis en ausencia de deficiencias específicas.
Se estima que el 50% de todos los pacientes con cáncer consumen productos médicos complementarios o alternativos, siendo los suplementos multivitamínicos una gran parte de estos. La deficiencia de vitamina D se ha asociado con la incidencia de cáncer, pero análisis de ensayos controlados aleatorizados no mostraron que la suplementación de vitamina D reduzca significativamente los resultados esqueléticos o no esqueléticos. Similarmente, la suplementación a largo plazo con vitamina E o selenio no tuvo efecto beneficioso en la incidencia de cáncer de próstata.
En pacientes con cáncer que pierden peso y tienen resistencia a la insulina, se recomienda aumentar la proporción de energía de grasas respecto a la de carbohidratos para incrementar la densidad energética de la dieta y reducir la carga glucémica. En pacientes con resistencia a la insulina, la absorción y oxidación de glucosa por las células musculares está dañada; sin embargo, la utilización de grasa es normal o aumenta, sugiriendo un beneficio en aumentar la proporción de grasa frente a carbohidratos. La grasa se moviliza y utiliza eficientemente como fuente de combustible en pacientes con cáncer. Parece prudente limitar los riesgos infecciosos asociados con la hiperglucemia.
No hay estudios clínicos que comparen los efectos de diferentes emulsiones de grasa en pacientes con cáncer, por lo que su rol aún no está claramente definido. Se recomienda la intervención nutricional para aumentar la ingesta oral en pacientes con cáncer que pueden comer pero están desnutridos o en riesgo de desnutrición, incluyendo consejería dietética y suplementos nutricionales orales. La terapia nutricional debe iniciarse antes de que la desnutrición sea severa, preferiblemente con asesoramiento nutricional y fomentando la ingesta de alimentos ricos en proteínas y energía. Se aconseja no restringir la ingesta energética en estos pacientes. Si la nutrición oral es insuficiente, se recomienda nutrición enteral, y si esta no es suficiente o factible, nutrición parenteral. En pacientes con cáncer que no pueden comer, digerir o absorber alimentos, el soporte nutricional puede estabilizar el estado nutricional. La nutrición enteral (NE) puede estabilizar el estado nutricional en pacientes con tumores que afectan la ingesta oral o el transporte de alimentos en el tracto gastrointestinal superior. En casos de insuficiencia intestinal severa, el estado nutricional puede mantenerse mediante nutrición parenteral (NP). Se recomienda incrementar la invasividad del enfoque nutricional solo después de evaluar cuidadosamente la insuficiencia del método oral más fisiológico. Los riesgos y beneficios de la NP deben considerarse cuidadosamente, especialmente para pacientes con un pronóstico de menos de dos meses. Si la ingesta de alimentos por vía oral ha disminuido significativamente durante un período prolongado, se recomienda aumentar la nutrición (oral, enteral o parenteral) lentamente durante varios días y tomar precauciones adicionales para prevenir el síndrome de realimentación, caracterizado por hipofosfatemia, desequilibrios de sodio y líquidos, y cambios en el metabolismo de glucosa, proteínas y grasas. Es prudente suministrar tiamina y un equilibrio de micronutrientes, vigilando y ajustando los electrolitos necesarios. Para pacientes con ingesta dietética crónicamente insuficiente y/o malabsorción incontrolable, se recomienda nutrición enteral (NE) o parenteral (NP) en casa en pacientes adecuados. La suspensión del soporte nutricional o la decisión de no iniciarla generalmente se considera solo en un contexto de fin de vida. Sin embargo, hay datos que muestran beneficios de la NE o NP domiciliaria en pacientes con cáncer con defectos crónicos de ingesta o absorción dietética, incluso en cáncer avanzado, siempre que haya una expectativa de vida de más de unas pocas semanas.
Se recomienda mantener o incrementar el nivel de actividad física en pacientes con cáncer para apoyar la masa muscular, la función física y el patrón metabólico. La actividad física, que incluye entrenamiento de intensidad moderada supervisado o en casa, es bien tolerada y segura en diferentes etapas del cáncer, incluidas las etapas avanzadas de la enfermedad. Se asocia con el mantenimiento o mejoras significativas en la capacidad aeróbica, fuerza muscular, calidad de vida relacionada con la salud, autoestima, y una reducción en la fatiga y la ansiedad. Se sugiere ejercicios de resistencia individualizados además de ejercicios aeróbicos para mantener la fuerza muscular y la masa muscular. Los pacientes con cáncer suelen reportar bajos niveles de actividad física, y tanto la inactividad como el tratamiento contra el cáncer tienen efectos adversos serios en la masa muscular. Una revisión sistemática reciente concluyó que tanto el ejercicio aeróbico como el de resistencia mejoran la fuerza muscular del cuerpo superior e inferior más que el cuidado usual.
Se sugiere considerar el uso de corticoesteroides para aumentar el apetito en pacientes con cáncer avanzado por un período limitado, siendo conscientes de sus efectos secundarios como pérdida muscular y resistencia a la insulina. Los progestágenos también pueden incrementar el apetito pero con posibles efectos adversos graves. Para pacientes con cáncer avanzado en quimioterapia y en riesgo de pérdida de peso, se sugiere el uso de suplementos de ácidos grasos omega-3 de cadena larga o aceite de pescado para estabilizar o mejorar el apetito, la ingesta de alimentos, la masa corporal magra y el peso corporal. A pesar de revisiones sistemáticas anteriores que reportaron evidencia insuficiente, estudios recientes muestran beneficios de los ácidos grasos omega-3 de cadena larga en pacientes con cáncer, mejorando apetito, peso, morbilidad postquirúrgica y calidad de vida. Los efectos secundarios son generalmente leves, aunque el sabor a pescado puede reducir la adherencia. Se ha observado una interacción entre el aceite de pescado y ciertos medicamentos, recomendando precaución. Por lo tanto, se ha emitido una recomendación débil para su uso, basada en beneficios nutricionales reportados y efectos secundarios leves. Para pacientes con saciedad temprana, se sugiere considerar agentes procinéticos, teniendo en cuenta sus posibles efectos adversos. Aunque hay evidencia limitada para suplementar con aminoácidos de cadena ramificada o mejorar la masa libre de grasa en pacientes con caquexia, y el uso de AINEs o cannabinoides para mejorar el peso corporal, trastornos del gusto o anorexia, se destaca la falta de datos clínicos consistentes para hacer recomendaciones firmes. Se resalta la necesidad de más investigación para establecer tratamientos efectivos en estas áreas.
Autor:

Carlos Ramos-Urrea
PhD. en Ciencias
¿Te gustaría profundizar en el manejo nutricional de pacientes oncológicos?




